背景介绍
本实验室当前主要关注的研究方向是微重力引起的脑结构和功能变化,以及这二者之间的相关。
在太空微重力环境下生活通常会给宇航员带来一系列的生理和病理变化,如肌肉萎缩,骨质流失,体液分布改变,激素水平变化,增高的肾结石和癌症风险等等。在已知的30余种太空环境对宇航员健康和行为的影响中,迄今仅有部分得到了一定的控制(NASA, 2015)。同时,人类的多种行为和认知能力在太空环境下都会显著降低(参见De la Torre (2014)的综述)。其中,最明显的是运动功能的减弱,包括反应速度,动作准确度,对时间的估计等受影响最明显。运动能力的减弱可能是很多太空事故的重要影响因素 (Ellis 2000)。在传统上认为,人在太空中各种心理能力的降低,主要是由于所处的特殊的环境造成的。例如舱室狭小,环境恶劣,与世隔绝,尤其是随时都有可能发生危险却几乎不可能逃生等环境因素使宇航员长期处在应激压力和焦虑状态下,对其多种生理状态和心理能力都有不同程度的危害。社会心理方面,长期的与社会隔离,宇航员团队内部的自治关系,以及宇航员与的与地面控制之间的不对称关系也有可能对宇航员的精神状态和认知产生影响, 例如在和平号空间站和国际空间站上都出现过宇航员之间的紧张关系公开化,以及宇航员与地面控制之间关系恶化的状况Kanas, Salnitskiy et al. 2007)。不过,一些较新的地面上模拟微重力环境的证据表明,微重力环境可能对人类的大脑活动有直接的影响而不需要通过焦虑和应激, 例如,反应时间降低(Lipnicki, Gunga et al. 2009),工作记忆变差(Liu, Zhou et al. 2015)等等。
尽管载人航天时代已经开始了半个世纪,绝大多数宇航员执行的都是短期(如飞船或航天飞机等少于两周的任务)或者中长期(如常驻国际空间站,约6个月)的任务。从2015年美俄才开始在国际空间站上部署停留期一年的宇航员,并在计划更长期的项目。因此,长期的微重力生活对宇航员生理的影响,特别是对神经系统的影响,我们现在所知相当有限。当前已知的微重力对大脑的直接影响,主要有两个方面:
(1) 长期(如超过六个月)在太空执行任务的男宇航员颅内压增高的风险很高(即VIIP, Vision Impairment and Intracranial Pressure,视觉缺陷与颅内压升高综合症)。颅内压升高会造成大脑神经元和神经纤维受力增加,虽然当前还没有直接的证据显示颅内压升高会对大脑的结构产生影响(研究表明单纯的颅内压升高对大脑结构(Hoffmann, Huppertz et al. 2013),灰白质比例(Yri, Fagerlund et al. 2014)等都没有显著影响),但是,一些研究表明颅内压升高的患者认知功能都弱于常人(McGeeney and Friedman 2014);在反应时间,反应速度空间记忆,注意力方面与正常人比较均有显著差异(Yri, Fagerlund et al. 2014)。
(2) 本实验室朱洵博士参与的Dr.Roberts课题组发现的微重力造成的大脑形态的显著变化(Roberts, 2015)。当以颅骨为参照时,模拟微重力下和实际长时间太空滞留后均发现大脑整体呈向枕部和顶部移动,即枕叶和顶叶脑区可能受到挤压; 同时,额叶的脑区体积缩小,脑回间距扩大(见下图动画)。
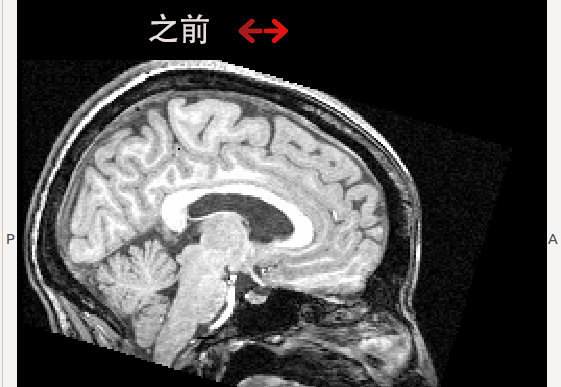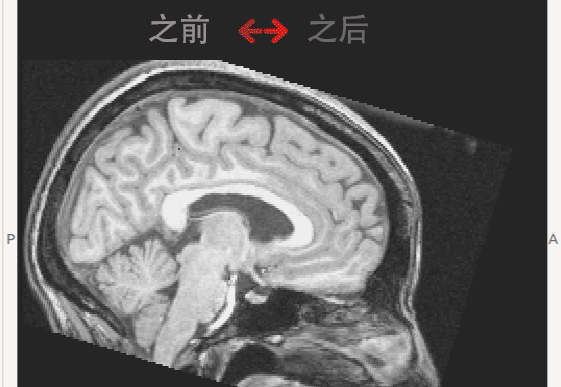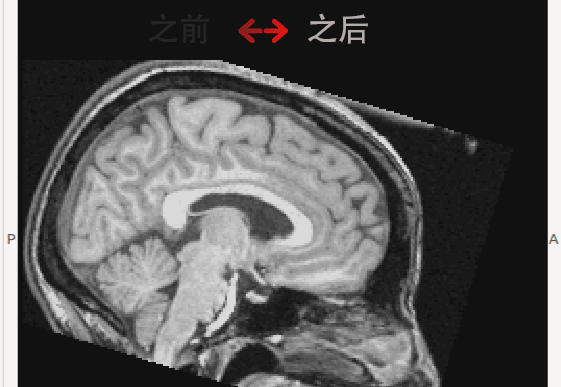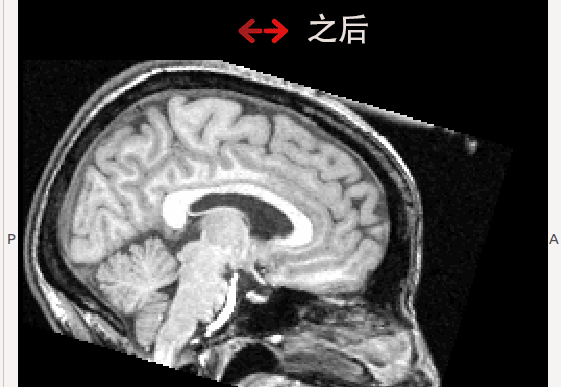
微重力可能导致大脑形态变化的现象不仅可以在在地面上的模拟微重力实验中被观察到。进一步的研究显示在宇航员中也可以观察到同样的变化,在且长期滞空的宇航员中更为显著。基于这一研究结果,本实验室预期在下面两个方面进行进一步的研究:
一. 脑形态的改变是否会影响到行为和认知能力,这二者是否有线性关系。
二. 脑形态的改变是否是导致了视觉缺陷与颅内压升高综合症(VIIP)。
脑形态变化对认知行为能力的影响
微重力环境显著影响运动和感觉皮质,尤其是初级运动皮质;另外受影响的还有枕叶视觉皮质,额叶皮质,但基本上不影响颞叶。从下图可见,整个运动皮质,尤其是Broadman Area 4,受累严重,而与之相邻的感觉皮质则受累轻得多:

其它主要受影响的还有枕叶视觉皮质,额叶皮质,但基本上不影响颞叶。值得注意的是,大脑的这些结构变化与在太空中的各种行为变化可能有紧密的联系。例如,研究表明顶叶运动皮质受到挤压,这与太空中肌肉会发生萎缩的现象是一致的;通常认为,宇航员在太空中发生肌肉萎缩的原因是缺乏锻炼以及失重引起的体液的流失,因此当前的应对方法是增加宇航员的运动量,以及使用特制的下身负压装置。我们的这一结果为更加深入的理解太空中的肌肉萎缩现象提供了新的思路。 而额叶的神经元参与到多种高级认知活动之中,在微重力下额叶的萎缩也很有可能与一系列高级认知心理能力的降低有关。
实验室成员朱洵博士在Dr.Roberts课题组中参与了研究了运动皮质结构改变对功能影响的研究。已知太空中下肢肌肉的萎缩显著重于上肢,因此,可以通过比较与上肢活动相关的神经活动和与下肢活动相关的神经活动受到影响的差异来研究结构和功能变化之间的相互关系。虽然在初级运动皮质(primary mortor cortex)中手和腿运动是由不同位置的神经元分别处理的,但是辅助运动区域(Supplementary motor area)则同时参与手和脚运动的处理。 fMRI结果显示,微重力对于辅助运动区上肢神经活动的影响,超过下肢:
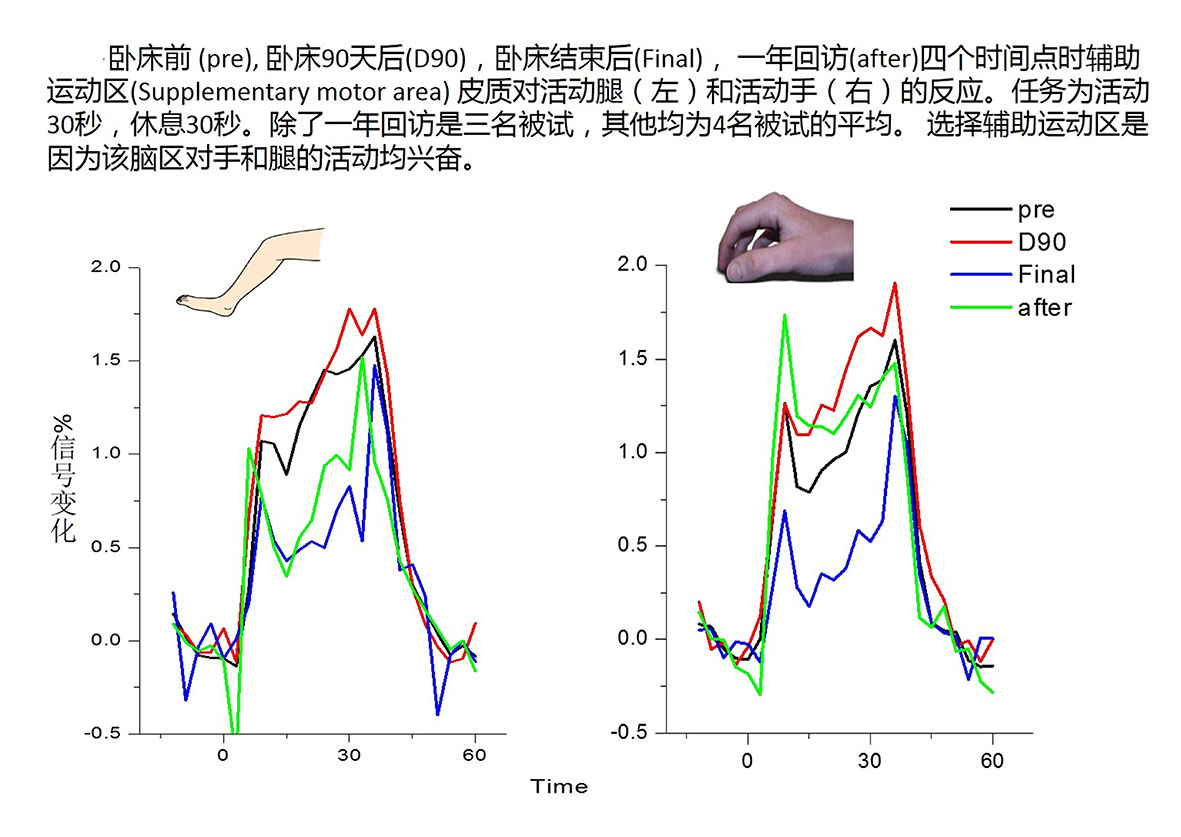
实验结果显示,虽然已知微重力或者头向下卧床等模拟微重力环境将导致肌肉萎缩和功能减低,但是与活动肢体相关的脑活动(以核磁BOLD信号计)非但没有减弱,反而较实验开始时为强。实验结束后,与肢体活动相关的脑兴奋水平均补偿性的显著降低至卧床前水平以下。一年的回访(三名被试)结果显示这一降低可能可以持续很长时间: 手指运动一年后已完全恢复,但腿运动仍未恢复到卧床前水平。与上肢活动相关的神经活动强度在微重力下增加更多,在实验结束后降低更多。与萎缩的肌肉相关的神经活动增加的原因尚不清楚,目前,我们认为可能的解释有如下二种,有待进一步实验的检验:
A运动皮层整体上互相挤压,使得单位体积内脑实质占有的空间更多(或者说脑脊液在此部分的相对比例减少),即神经元密度增加。神经元密度增加在脑影像信号上表现为单位体积内(即一个fMRI像素内)的兴奋程度增加;或
B 由于肌肉萎缩,因此神经元需要提升输出神经信号的强度以维持相同的对肌肉的控制力;
下一步实验室将在此方向更加深入的探索脑功能受脑结构改变程度影响的规律。微重力导致的脑形态改变是否影响脑功能,会影响哪些脑功能;以及脑形态的改变是否和脑功能的改变线形相关。在微重力下萎缩的额叶是高级联合皮质,影响着大多数的高级认知和意识活动,特别是决策的脑过程。这个区域的萎缩,对于这些功能特别是决策过程有什么样的影响,其影响是否与萎缩程度直接相关,我们将通过电生理,行为学和脑影像实验进行进一步的研究。
VIIP综合症的机理研究
许多长期滞留太空的男宇航员受到视力下降和远视的困扰,其中一些还不得不戴上眼镜工作。进一步的检查发现一系列由于颅内压增高而引起的视神经和眼球的病理改变。NASA(美国航空航天署)在2010年正式使用VIIP(Vision Impairment and Intracranial Pressure,视觉缺陷与颅内压升高)综合症这一术语来描述这一系列的生理病理变化,并将其列为长期太空旅行的重要威胁之一(NASA, 2015)。
VIIP综合症的症状大致出现在升空数月以后,虽然根据Mader, Gibson et al. (2011)对300名宇航员的问卷调查,执行过短期任务的宇航员中即有29%报告有视力下降(而在国际空间站上停留过6个月的宇航员中这一比例则高达60%)。一项研究显示在国际空间站上停留过6个月以上的36名美国宇航员中有15名被NASA确诊为VIIP,其中4名为最严重的第四级 (Tarver and Otto 2012)。 VIIP综合症的一个显著流行病学特点是主要影响男性,且以年纪较大、升空次数较多的宇航员为甚。Krama, 2012的研究显示,受VIIP影响的宇航员表现出程度不同的眼球和视神经结构变化(见下图. 改编自Nelson, Mulugeta et al. 2014)。
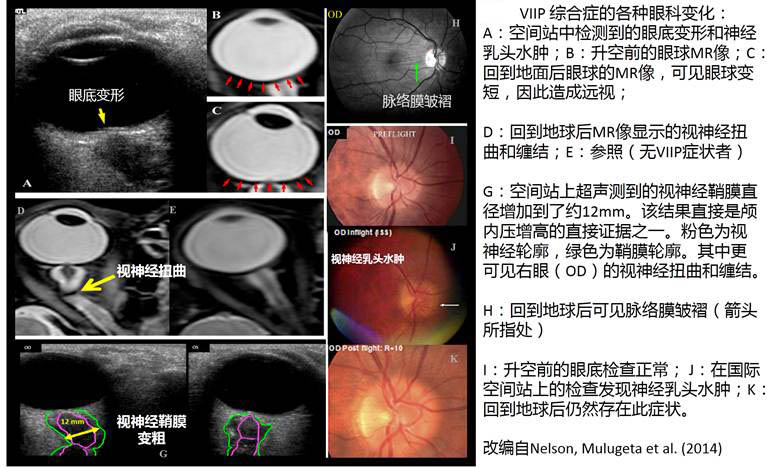
对于这些变化,主流看法是与颅内压升高相关。包括视神经在内的视器是胚胎发生时从间脑向外突出形成的,因此视神经外面包覆有由三层脑膜延续而来的三层被膜,脑蛛网膜下腔也延续到视神经周围。尸体上的研究证实视蛛网膜下腔内的压力正比于颅内压(Liu and Kahn 1993)。因此,视力的变化被认为是颅内压变化的一个灵敏的临床指标。在地面上,没有明显脑肿瘤或外伤的颅内压升高患者,即特发性颅内压增高症(IIH, idiopathic intracranial hypertension)患者表现出相似的眼科症状(Friedman and Jacobson 2002)。更直接的证据为4名宇航员回地球后的腰部穿刺测量发现中等程度的颅内压升高(210~285毫米水柱)(Mader, Gibson et al. 2011);以及在空间站上测量发现的视神经鞘直径增加(参见上图G)。如下图所示,基于颅内压升高的假设能较好地解释VIIP综合症中视神经和眼球的病理变化。

虽然大多数研究者同意颅内压的变化(更准确的说是颅内压与眼内压之间的压力差变化)是导致视觉变化的原因,但是太空微重力通过什么机理导致颅内压升高,迄今尚无定论。主要的理论可归为以下三个方向:
影响血脑屏障假设
二氧化碳(CO2)是一种强效血管扩张剂,从而能降低脑血管的阻力,显著增加脑血流,削弱血脑屏障,提高脑脊液产生速度;由于上述效应可使颅内物质总量增加,因而有可能提高颅内压(Wei, Seelig et al. 1984)。国际空间站中的二氧化碳分压为2.3~5.2mmHg(James 2007),大约是地面上的十倍。研究表明,宇航员从国际空间站返回后,二氧化碳对他们脑血流和脑血管阻力的调控能力显著降低(Zuj, Arbeille et al. 2012, Taylor, Hanna et al. 2013),证实宇航员在空间站耐受了高浓度的二氧化碳环境。因应此方面的争议,国际空间站上的二氧化碳浓度已被调低。据我所知,欧洲航天局今年计划在德国开展一项富二氧化碳环境下的长期头向下卧床研究,试图阐明这方面的风险。
与二氧化碳类似,研究表明辐射也能弱化血脑屏障(Lakin, Stevens et al. 2007),从而以相似机理机制导致颅内压增加。猪试验证实长期暴露于电离辐射下能导致颅内压显著升高(Sanzari, Muehlmatt et al. 2014)。电磁辐射如手机辐射也有报道有相似影响血脑屏障作用(Nittby, Brun et al. 2009).
影响代谢假设
Zwart, Gibson et al. (2012)的研究发现,受VIIP综合症影响的宇航员血清中高半胱氨酸,胱硫醚,2-甲基柠檬酸,甲基丙二酸等一碳代谢产物水平与无症状的宇航员相比明显升高。此研究暗示代谢水平或通路在太空中的改变可能与VIIP综合症相关。与此类似,由于在太空中人的味觉显著降低,太空食物普遍高盐,平均每天摄入量可达5克,因此也有假设认为颅内压升高与此有关(Alexander et.al. 2012)。
脑血管血流变化假设
微重力或模拟微重力(如头向下卧床)均能影响到压力平衡(例如图五),导致体液的头向移动,包括增加动脉血流和潴留静脉血流。动脉血流增加将增加脑灌注压力,从而导致颅内压升高。Murthy, Marchbanks et al. (1992)证实10分钟的头向下卧床即可导致颅内压显著升高。不过,但如果脑血流自主调控能力没有受损的话,这些变化应该能很快被代偿(Aaslid 2006, Taylor, Hanna et al. 2013),而不至于出现长期的颅内压升高。如Kawai, Murthy et al. (1993)发现,头向下卧床的受试者脑血流速度在卧床开始后持续增加,并在3小时内达到顶点;之后在9小时内逐渐回到基础水平。兔子实验表明,头向下卧床引起的颅内压升高大约在12小时时达到顶点,然后在7天内降回卧床前水平(Tatebayashi, Asai et al. 2003)。 因此,动脉端的这类变化可能与进入太空2~3天时发生的空间适应症(space adaptation syndrome,Jennings, (1990))或者空间晕动症(space motion sicknes, Thornton,et al. (1987))更相关。现有的证据表明,宇航员回到地面后其脑血流速度与升空前并无显著差异(Iwasaki, Levine et al. 2007, Alexander et.al. 2012)。然而,研究表明在太空中停留13天后的老鼠,其脑血管的收缩能力降低,扩张度增加,血管的韧性和弹性模量均降低(Taylor, Hanna et al. 2013)。此研究显示即使脑血流保持不变,由于血管阻力的减小,颅内压仍然可能藉此机理增高。
静脉端的变化同样可能导致颅内压改变,如静脉狭窄或颈内静脉的折叠等均能引起颅内压相关的视觉变化(Cheng, Chang et al. 2013)。与动脉端主要通过血流变化影响颅内压稍有不同的是,静脉端主要是通过血压变化影响颅内压。矢状窦旁的蛛网膜绒毛将脑脊液回渗到上矢状窦,使脑脊液回流至静脉系统。因此,脑脊液的吸收平衡主要取决于颅内静脉压和脑脊液间压力差以及脑脊液回收细胞的渗透压水平.经典的对脑静脉血压和颅内压间关系为Davson公式(Davson, Hollingsworth et al. 1970):
Pcsf = Psss + F × R
其中
Pcsf 为脑脊液的压力;
Psss 为上矢状窦(Superior sagittal sinus,SSS)内的静脉血压压力;
F 为CSF生成速度
R 为CSF渗透阻力/流出阻力。
即,在CSF生成速率与CSF流出阻力都不变的情况下,上矢状窦内的静脉血压力与颅内压成线性关系。如果从上矢状窦(SSS,Superior sagittal sinus,)至心脏之间的静脉血流排出通路受阻,造成SSS内的血液压力增大,即会间接的导致颅内压增高(Herault, Fomina et al. 2000, Wilson, Imray et al. 2011)。MRI研究发现,当采取卧位时,脑静脉血流出颅后多由颈内静脉 (IJV,Internal jugular vein)排出,而直立位时,血液本身的重量不足以撑开颈内静脉(即,颈内静脉因四周组织的压力而闭合(collapse)),血流多由次级静脉如椎静脉和颈深静脉等通路流出(Alperin, Lee et al. 2005); 只有当静脉内压力增加到一定程度时才足以撑开颈内静脉(Gisolf, van Lieshout et al. 2004)。Wiener(2012)基于此提出了空间障碍综合征假设(space obstructive syndrome): 由于太空中的血液没有重量,因此静脉血流的通路及血管受压状况与地面不同;这些的改变导致静脉血流阻力发生变化,因此颅内静脉窦处在排泄不畅,压力增高的状态。颅静脉窦内血压的增高会直接导致脑脊液压力的增高。
综上所述,试图解释VIIP综合症中颅内压升高机制的理论已有不少。但是,大多数无法同时解释VIIP综合症的两个主要流行病学特征,即:
一,与空间适应症或者空间晕动症等一过性、主要出现在升空头2~3天不同,VIIP一般在滞空较久后才出现;有证据表明其与滞留太空时间相关,而且研究发现眼科症状和颅内压升高在回到地球后很久仍然存在(Mader,2011);
二,已知的受VIIP综合症影响者均为男性。虽然由于女性宇航员的数量远少于男性,因此很难说女性对VIIP免疫;但是在VIIP的易感性上有显著的性别差异无可置疑。
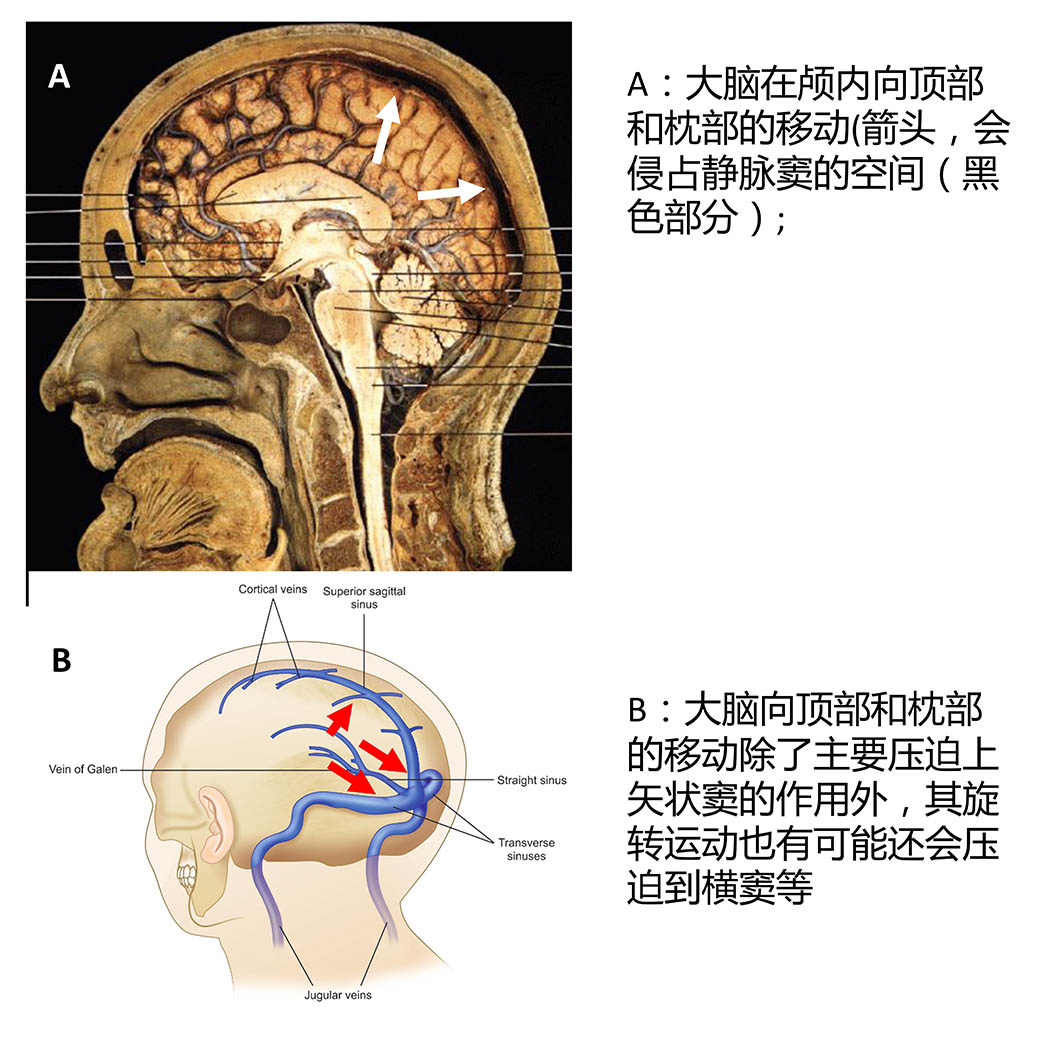
这两个特点显示微重力或者太空环境并不直接导致VIIP综合症,而是间接的通过影响某种可积累性的因素引发VIIP(依据特征一), 而且此因素有显著的性别差异。因此,基于重力改变引起的体液分布变化、脑血流速度和路径变化等的假设很难解释VIIP的渐进性和积累性特点;而基于辐射,代谢,血脑屏障改变的假设又无法解释性别差异。而前文所述的微重力导致脑形态变化的发现为探索VIIP综合症的机制提出了新的思路, 即VIIP的颅内静脉受压迫假设:与Wiener(2012)的空间障碍综合征假设主要基于离开颅脑后的静脉血流变化不同,Dr.Roberts 提出颅内静脉形态的改变也可能是VIIP综合症中颅内压升高的重要原因。由于微重力引起大脑在颅内向顶部和枕部的扩张移动,而颅内空间是有限的, 因此脑实质在颅内移动和分布改变模式,会侵占脑静脉窦的空间,在事实上起到压迫颅内静脉的效果:
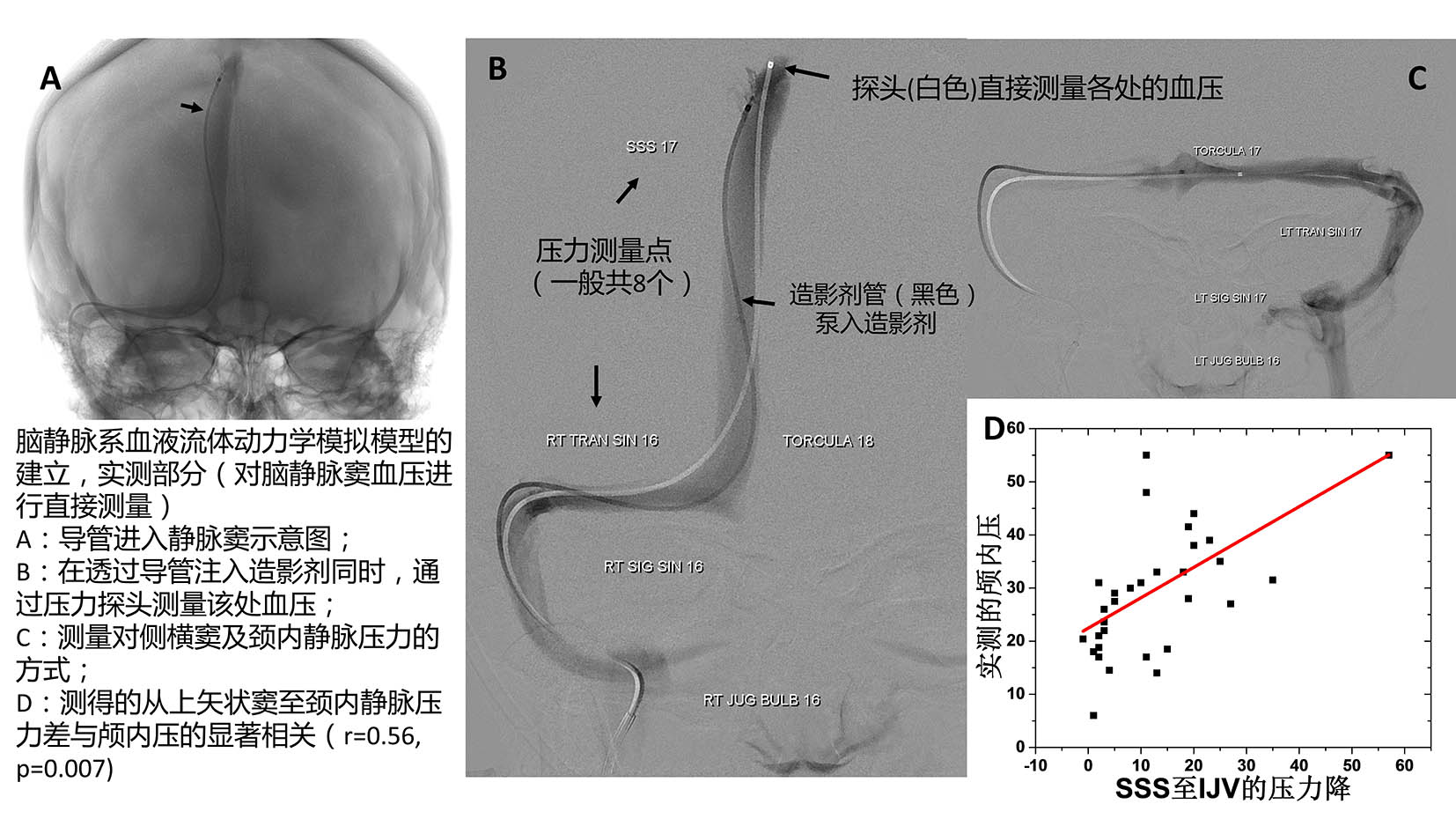
为了验证这一假设,我们需要估计静脉血流过脑静脉窦系统的过程将产生多大的压力降,以及微重力作用后这一压力降会有多大的变化。这个压力降可以通过插入静脉导管的方式来测量,但是由于这是一个外科手术,显然不适合于科研目的。 因此,我们选择采用流体力学计算的方式来间接的估计这一压力降。目前Dr.Roberts研究组选择了26名接受基于导管的静脉造影手术(invasive catheter-based venography的)的特发性颅内压增高症(IIH, idiopathic intracranial hypertension)患者建立实验模型。如前所述,IIH患者脑内无明显肿瘤或损伤,但是颅内压原因不明的明显升高。其中我们选取的这些患者均在血管造影成像上可见脑静脉狭窄(dural sinus stenosis)。 该手术把造影剂导管和压力探头直接导入颅内静脉各处,释放造影剂并直接测量脑静脉内的血压,如果某两点之间的压力差大于一定值,则作为考虑安放支架的指证。在包括这些病人在内的33名患者(之中7名患者因为各种原因之测定了一侧,没有测到双侧的压力,因此未包含在上述26名患者中)中得到的数据与Davson公式预计符合,即从上矢状窦(SSS,superior sagittal sinus)至双侧颈内静脉(IJV,Internal jugular vein)的平均压力降与直接腰穿测量得到的颅内压显著相关(见下图)。
模拟血液的流动与模拟其他流体有很大的不同,其一,血液是非牛顿流体, 因此模拟复杂性大大增加;其二,血液在静脉血管中的流动虽然按雷诺数属于层流区间,但是由于血管形状复杂,实际上血液的流动是湍流;其三,心跳带来的血液的搏动性流动,血管壁不是刚体(例如会收缩或扩张),以及静脉中的阀等,都对流体动力学模拟带来的复杂性。虽然由于脑静脉窦的特殊性(例如没有平滑肌和阀(因此血管壁可以考虑为刚体),也没有血流的搏动等),减少了很多的复杂性,但是进行精确的模拟,仍然困难重重。因此,我们的现阶段策略是极大的简化所有的变量,将所有的其他复杂因素归结为线性校正系数。即,把实测值与模拟值之间的关系归纳为: P真实值 = A × P模拟值 + B; 因此,如果模拟值和真实值(即探头测到的实测值)显著相关的话,我们即可求出校正系数 A与B。我们忽略的变量为: A) 血液的性质,即认为血液为牛顿流体; B) 血管的结构,即仅包括了从上矢状窦后三分之二至双侧颈内静脉出颅处间的颅内段主干, 略去其他所有汇入小血管; C) 颅外血管的因素,即认为左右颈内静脉中的血液出颅后遇到的阻力是一样的。 如下图-II所示我们首先从磁共振血管造影(MRA)影像中提取出脑静脉窦系统的结构,并将其数字化和网格化(mesh)。为了简单起见,现阶段我们仅包括了从SSS至双侧IJV的颅内段主干(包括入其它小血管将大大增加计算复杂度超出我们现有的计算能力)。然后用流体动力学计算软件openFoam模拟从SSS至双侧IJV的血液流动,并计算其压力降。经过条件摸索,当前我们认为以k-ε湍流模型为基础,设定脑血流量为60毫升/百毫升脑实质组织/分钟时,计算值与手术中测量到的实际值的相关性最好。

其中, 实测-模拟关系的斜率小于一,而截距大于零, 我们认为前者是由于忽略了其它汇入的小血管所致(即主血管中的实际血流在出口处大于入口),而后者是由于忽略了血液的剪切变稀性,因此导致实际血液粘度小于设定值所致。虽然血管内血液流动的流体动力学模拟已经开展多年(Bessonov, et.al, 2016),据申请人所知,这是国际上第一次成功的建立有活体数据验证的人脑静脉血液流动的血液动力学模型。基于成功建立的这一模型,我们将可以仅仅依靠MRA影像估算血液流经脑静脉窦系造成的血压降。根据NASA对VIIP的诊断标准,颅内压 >25厘米水柱 为4级, 小于25厘米水柱为1~3级,因此如果计算得到的脑静脉系卧床前后压力差变化接近5厘米水柱,我们就可以较有把握的认为此类变化是VIIP颅内压升高的重要原因。
研究方法
在地面上,-6°头向下卧床是经典的模拟微重力对人体影响的实验手段。NASA以这类研究模拟微重力状态已约四十年(Meck, Dreyer et al. 2009),国内宇航员训练中心也开展着这方面的工作。头向下卧床实验的概念很简单,其基本原理是认为人体在太空中发生的生理变化在根本上归于重力变化引起的体液分布改变,而当人平躺时候的体液压力分布正好和微重力时的相同。不使用完全平躺,而采用头向下卧床的是为了模拟太空中发生的体液向头部的移动(cephalad shifting of bodily fluids);而选用-6°的原因是载人航天时代初期苏联宇航员返回地面后,总觉得躺在床上时自己在向前滑动;通过调节床为向上6°倾斜才消除这一感觉。(Pavy-Le Traon, Heer et al. 2007)因此,人们就用长期-6°头向下卧床来模拟太空。

该研究手段是一个非常好的研究平台,因为在头向下卧床实验里,被试每天可有超过6小时的时间接受各种研究;各种研究内容之间不是排它的,研究团队成员可以以很低的附加成本在这个实验平台上同时进行微重力对人心理生理影响的大量研究。
相关文献
Alexander, D.J.; Gibson, C.R.; Hamilton, D.R.; Lee, S.M.C.; Mader, T.H.; Otto, C.; Oubre, C.M.; Pass, A.F.; Platts, S.; Scott, J.M.; et al. Evidence Report: Risk of Spaceflight-Induced Intracranial Hypertension and Vision Alterations; NASA: Washington, DC, USA, 2012. Available at:
http://humanresearchroadmap.nasa.gov/evidence/reports/VIIP.pdf
Aaslid, R. (2006). "Cerebral autoregulation and vasomotor reactivity." Front Neurol Neurosci 21: 216-228.
Alperin, N., S. H. Lee, A. Sivaramakrishnan and S. G. Hushek (2005). "Quantifying the effect of posture on intracranial physiology in humans by MRI flow studies." J Magn Reson Imaging 22(5): 591-596.
Bessonov, N.; Sequeira, A.; Simakov, S.; Vassilevskii, Yu.; Volpert, V. (2016) Methods of Blood Flow Modelling; Mathematical Modelling of Natural Phenomena; 11(1):1-25
Cheng, C. Y., F. C. Chang, A. C. Chao, C. P. Chung and H. H. Hu (2013). "Internal jugular venous abnormalities in transient monocular blindness." BMC Neurol 13: 94.
Davson, H., G. Hollingsworth and M. B. Segal (1970). "The mechanism of drainage of the cerebrospinal fluid." Brain 93(4): 665-678.
De la Torre, G. G. (2014). "Cognitive neuroscience in space." Life (Basel) 4(3): 281-294.
Ellis, S. R. (2000). "Collision in space." Ergon Des 8(1): 4-9.
Friedman, D. I. and D. M. Jacobson (2002). "Diagnostic criteria for idiopathic intracranial hypertension." Neurology 59(10): 1492-1495.
Gisolf, J., J. J. van Lieshout, K. van Heusden, F. Pott, W. J. Stok and J. M. Karemaker (2004). "Human cerebral venous outflow pathway depends on posture and central venous pressure." J Physiol 560(Pt 1): 317-327.
Herault, S., G. Fomina, I. Alferova, A. Kotovskaya, V. Poliakov and P. Arbeille (2000). "Cardiac, arterial and venous adaptation to weightlessness during 6-month MIR spaceflights with and without thigh cuffs (bracelets)." Eur J Appl Physiol 81(5): 384-390.
Hoffmann, J., H. J. Huppertz, C. Schmidt, H. Kunte, L. Harms, R. Klingebiel and E. Wiener (2013). "Morphometric and volumetric MRI changes in idiopathic intracranial hypertension." Cephalalgia 33(13): 1075-1084.
Iwasaki, K., B. D. Levine, R. Zhang, J. H. Zuckerman, J. A. Pawelczyk, A. Diedrich, A. C. Ertl, J. F. Cox, W. H. Cooke, C. A. Giller, C. A. Ray, L. D. Lane, J. C. Buckey, Jr., F. J. Baisch, D. L. Eckberg, D. Robertson, I. Biaggioni and C. G. Blomqvist (2007). "Human cerebral autoregulation before, during and after spaceflight." J Physiol 579(Pt 3): 799-810.
James, J. T. (2007). The Headache of Carbon Dioxide Exposures. International Conference on Environmental Systems: Houston (TX): NASA Johnson Space Center;.Technical report
Jennings, T. (1990). "Space adaptation syndrome is caused by elevated intracranial pressure." Med Hypotheses 32(4): 289-291.
Kanas, N. A., V. P. Salnitskiy, J. E. Boyd, V. I. Gushin, D. S. Weiss, S. A. Saylor, O. P. Kozerenko and C. R. Marmar (2007). "Crewmember and mission control personnel interactions during International Space Station missions." Aviat Space Environ Med 78(6): 601-607.
Kawai, Y., G. Murthy, D. E. Watenpaugh, G. A. Breit, C. W. Deroshia and A. R. Hargens (1993). "Cerebral blood flow velocity in humans exposed to 24 h of head-down tilt." J Appl Physiol (1985) 74(6): 3046-3051.
Lakin, W. D., S. A. Stevens and P. L. Penar (2007). "Modeling intracranial pressures in microgravity: the influence of the blood-brain barrier." Aviat Space Environ Med 78(10): 932-936.
Li, K., X. Guo, Z. Jin, X. Ouyang, Y. Zeng, J. Feng, Y. Wang, L. Yao and L. Ma (2015). "Effect of Simulated Microgravity on Human Brain Gray Matter and White Matter--Evidence from MRI." PLoS One 10(8): e0135835.
Lipnicki, D. M., H. C. Gunga, D. L. Belavy and D. Felsenberg (2009). "Bed rest and cognition: effects on executive functioning and reaction time." Aviat Space Environ Med 80(12): 1018-1024.
Liu, Q., R. Zhou, X. Zhao and T. P. Oei (2015). "Effects of prolonged head-down bed rest on working memory." Neuropsychiatr Dis Treat 11: 835-842.
Liu, D. and M. Kahn (1993). "Measurement and relationship of subarachnoid pressure of the optic nerve to intracranial pressures in fresh cadavers." Am J Ophthalmol 116(5): 548-556.
Mader, T. H., C. R. Gibson, A. F. Pass, L. A. Kramer, A. G. Lee, J. Fogarty, W. J. Tarver, J. P. Dervay, D. R. Hamilton, A. Sargsyan, J. L. Phillips, D. Tran, W. Lipsky, J. Choi, C. Stern, R. Kuyumjian and J. D. Polk (2011). "Optic disc edema, globe flattening, choroidal folds, and hyperopic shifts observed in astronauts after long-duration space flight." Ophthalmology 118(10): 2058-2069.
McGeeney, B. E. and D. I. Friedman (2014). "Pseudotumor cerebri pathophysiology." Headache 54(3): 445-458.
Meck, J. V., S. A. Dreyer and L. E. Warren (2009). "Long-duration head-down bed rest: project overview, vital signs, and fluid balance." Aviat Space Environ Med 80(5 Suppl): A1-8.
Murthy, G., R. J. Marchbanks, D. E. Watenpaugh, J. U. Meyer, N. Eliashberg and A. R. Hargens (1992). "Increased intracranial pressure in humans during simulated microgravity." Physiologist 35(1 Suppl): S184-185.
NASA (2015). "NASA's Efforts to Manage Health and Human Performance Risks for Space Exploration - Human Mars Missions, Astronaut Health Care, Radiation, Vision Impairment and Intracranial Pressure, Nutrition." Report No. IG-16-003. Avaliable at: https://oig.nasa.gov/audits/reports/FY16/IG-16-003.pdf
Nelson, E. S., L. Mulugeta and J. G. Myers (2014). "Microgravity-induced fluid shift and ophthalmic changes." Life (Basel) 4(4): 621-665.
Nittby, H., A. Brun, J. Eberhardt, L. Malmgren, B. R. Persson and L. G. Salford (2009). "Increased blood-brain barrier permeability in mammalian brain 7 days after exposure to the radiation from a GSM-900 mobile phone." Pathophysiology 16(2-3): 103-112.
Pavy-Le Traon, A., M. Heer, M. V. Narici, J. Rittweger and J. Vernikos (2007). "From space to Earth: advances in human physiology from 20 years of bed rest studies (1986-2006)." Eur J Appl Physiol 101(2): 143-194.
Roberts, D. R., X. Zhu, A. Tabesh, E. W. Duffy, D. A. Ramsey and T. R. Brown (2015). "Structural Brain Changes following Long-Term 6 degrees Head-Down Tilt Bed Rest as an Analog for Spaceflight." AJNR Am J Neuroradiol 36(11): 2048-2054.
Sanzari, J., A. Muehlmatt, A. Savage, L. Lin and A. Kennedy (2014). "Increased intracranial pressure in mini-pigs exposed to simulated solar particle event radiation." Acta Astronaut 94(2): 807-812.
Tarver, W. J. and C. Otto (2012). NASA’s Spaceflight Visual Impairment Intracranial Pressure (VIIP) Risk: Clinical Correlations and Pathophysiology. Aerospace Medicine Grand Rounds. NASA: Washington, DC, USA.
Tatebayashi, K., Y. Asai, T. Maeda, Y. Shiraishi, M. Miyoshi and Y. Kawai (2003). "Effects of head-down tilt on the intracranial pressure in conscious rabbits." Brain Res 977(1): 55-61.
Taylor, C. R., M. Hanna, B. J. Behnke, J. N. Stabley, D. J. McCullough, R. T. Davis, 3rd, P. Ghosh, A. Papadopoulos, J. M. Muller-Delp and M. D. Delp (2013). "Spaceflight-induced alterations in cerebral artery vasoconstrictor, mechanical, and structural properties: implications for elevated cerebral perfusion and intracranial pressure." FASEB J 27(6): 2282-2292.
Thornton, W. E., T. P. Moore, S. L. Pool and J. Vanderploeg (1987). "Clinical characterization and etiology of space motion sickness." Aviat Space Environ Med 58(9 Pt 2): A1-8.
Wei, E. P., J. M. Seelig and H. A. Kontos (1984). "Comparative responses of cerebellar and cerebral arterioles to changes in PaCO2 in cats." Am J Physiol 246(3 Pt 2): H386-388.
Wiener, T. C. (2012). "Space obstructive syndrome: intracranial hypertension, intraocular pressure, and papilledema in space." Aviat Space Environ Med 83(1): 64-66.
Wilson, M. H., C. H. Imray and A. R. Hargens (2011). "The headache of high altitude and microgravity--similarities with clinical syndromes of cerebral venous hypertension." High Alt Med Biol 12(4): 379-386.
Yri, H. M., B. Fagerlund, H. B. Forchhammer and R. H. Jensen (2014). "Cognitive function in idiopathic intracranial hypertension: a prospective case-control study." BMJ Open 4(4): e004376.
Zuj, K. A., P. Arbeille, J. K. Shoemaker, A. P. Blaber, D. K. Greaves, D. Xu and R. L. Hughson (2012). "Impaired cerebrovascular autoregulation and reduced CO(2) reactivity after long duration spaceflight." Am J Physiol Heart Circ Physiol 302(12): H2592-2598.
Zwart, S. R., C. R. Gibson, T. H. Mader, K. Ericson, R. Ploutz-Snyder, M. Heer and S. M. Smith (2012). "Vision changes after spaceflight are related to alterations in folate- and vitamin B-12-dependent one-carbon metabolism." J Nutr 142(3): 427-431.
